- Partage ce devoir avec tes amis !
Sujet du devoir
bonsoir je suis bloque sur une question : calculer la masse de cette espèce à prélever pour préparer 100 ml de cette boisson isotonique ?
Donne : 180 g. Mol -1

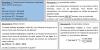
Images concernant mon devoir de Chimie
Où j'en suis dans mon devoir
donne mise a jour voir illustrations merci
12 commentaires pour ce devoir
Oui désolé je me suis trompé, j'ai confondu M et Cm, je ne sais pas pourquoi en plus....
Salut, j'ai vu la photo que tu as ajouté.
Donc je t'avais dis qu'il faut trouver la masse avec la formule suivabte: m= Cm × Vs
Donc: m=1.80×100×10puissance-3 car c'est en ml.
m=0.18g
D'après moi c'est ça, mais dans la a) on te demande l'espèce qui est un solide. C'est donc le NaCl, et dans la b) que je viens de résoudre ils demandent de trouver la masse de l'espèce à prélever. Parlent-ils de l'espèce NaCl ?
oui il parlent de l'espece de NaCI
Merci beaucoup pour ton aide tu est entrain de sauver mon orientation :)
J'ai l'impression qu'il manque encore des informations ! on ne sait pas ce qu'il faut mélanger pour obtenir la boisson ...
Peux-tu donner le sujet entier afin d'obtenir une meilleure aide ?
dacord
voila les derniere information en ilustration
Tout d'abord, d'après moi il faut connaitre le nombre de moles de NaCl pour 100ml de boisson. Je pense que cela revient à additionner le nombre qu'il faut d'ion sodium et d'ion chlorure. Donc : 14+14=28 mmol = 28*10^(-3) mol = 0,028mol
Sachant que n=m/M alors m la masse vaut n*M donc le nombre de mole multiplié par la masse molaire du NaCl (soit 58,5). L'application numérique vaut : 28*10^(-3) * 58,5 = 1,638 g
Ils ont besoin d'aide !
- Aucun devoir trouvé, poste ton devoir maintenant.
La masse est relié par la relation
m= C molaire × V solution
Donnes tout l'énoncé correctement
T'es sur de toi ? Parce que l'homogénéité de ton équation n'est pas vérifié ...
Toi même tu dis que c'est la concentration molaire qu'il faut multiplier par le volume de la solution (je suis d'accord avec toi), or ce qui est donné est la masse molaire M !
La concentration molaire est en g/L alors que la masse molaire est en g/mol
D'après moi, tu ne nous donne pas assez d'informations pour résoudre le problème. Il est impossible de trouver des grammes avec des g/mol et des litres ... (Désolé ça fait 2 ans que j'ai pas fait de chimie je peux me tromper).
Bonjour, oui il manque une valeur,
tu nous donnes le volume et la masse molaire,
mais tu ne nous donnes pas la valeur de la concentration de la solution que tu veux préparer...
Jai mis une illustration au dessus vous la trouverez (les donnés manquant)